Deze studie zal de biologische effecten analyseren van extreem laagfrequente elektrische en magnetische velden.
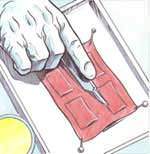
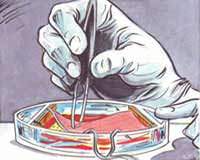
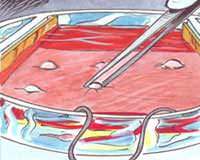
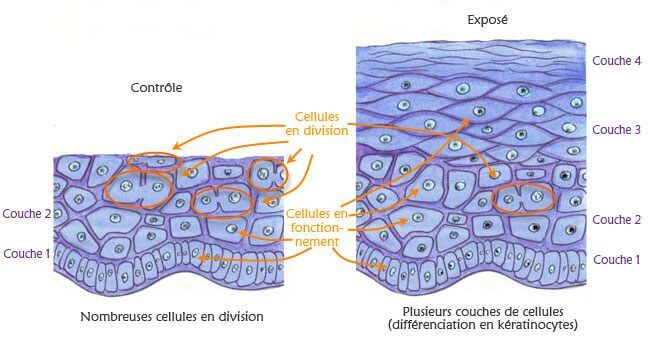
Keratinocyten, cellen in de buitenste laag van de menselijke huid (epidermis) worden op een stukje gedecellulariseerde dermis aangebracht, de binnenste laag van de menselijke huid. Het elektrische signaal wordt aangelegd met twee platina elektroden. De genactivering in blootgestelde cellen wordt vergeleken met die in cellen na gesimuleerde blootstelling.
Dit model van epidermaal herstel en elektrisch signaal biedt een vereenvoudigd en goed gekarakteriseerd model om de biologische effecten van elektromagnetische stimulatie te bestuderen.
Hierna worden de studie en haar belangrijkste resultaten voorgesteld.